【論文掲載】温泉科学 68巻3号(2題の論文が掲載されました)
今回、サラヴィオの2つの論文が学術雑誌「温泉科学」に掲載され、医療やライフサイエンスに加えて温泉科学の分野でも認められました。
「温泉科学」は80年の歴史と権威を持つ日本温泉科学会から発行される専門誌です。
これまでに、京都大学、九州大学、産総研等の専門家が論文を発表し、国内の温泉研究を牽引してきましたが、温泉に生息する藻類の健康・美容効果として初めて掲載されました。
薄毛や脱毛症、お肌の痒みや赤み、体の痛みや腫れ等でお悩みの方が、より安心して商品をお使い頂けるように、今後も温泉研究のパイオニアとして科学的根拠をもとにした商品開発を進めていきたいと思います。
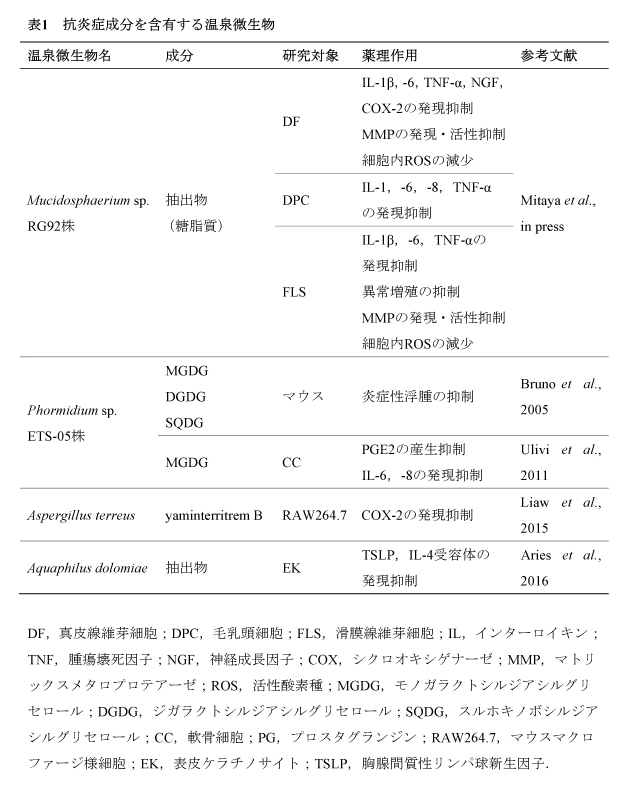
論文タイトル「別府温泉由来微細藻類RG92株の抗炎症作用」
要旨
温泉療法は関節炎や皮膚疾患などの炎症性疾患の治療に有用であるという報告がある.温泉には多様な微生物が生息しており,炎症を抑える成分を産生する微生物も見出されている.我々は,別府温泉において有用微生物の単離・探索を繰り返し,緑藻Mucidosphaerium sp. RG92株を含むいくつかの温泉微生物を発見した.今回は,RG92株抽出物の皮膚および関節細胞における抗炎症作用について解説する.
RG92株抽出物はインターロイキン1β(IL-1β)で刺激した真皮線維芽細胞(DF),毛乳頭細胞,滑膜線維芽細胞(FLS)のいずれにおいてもIL-1βやIL-6,腫瘍壊死因子α(TNF-α)といった様々な炎症疾患に関わる炎症性サイトカインの遺伝子およびタンパク質の発現を抑制した.DFにおいては,皮膚の掻痒やシワに関わるシクロオキシゲナーゼ-2,神経成長因子,マトリックスメタロプロテアーゼ1(MMP-1),MMP-3の発現やMMP酵素活性の抑制も認められた.また,FLSでは,RG92株抽出物は関節炎に関与するMMP-1,MMP-3,MMP-9の発現やこれらの酵素活性,細胞増殖活性を減少させた.さらに,同抽出物の活性酸素種(ROS)消去活性は178.3 ± 0.9 μmol trolox equivalent/gであり,実際に細胞内のROS量を低下させた.
以上のことから,緑藻Mucidosphaerium sp. RG92株の抽出物はROSと種々の炎症メディエーターを介して皮膚や関節細胞の炎症反応を抑えることが考えられ,炎症性疾患の予防・改善に有用であることが示唆された.
キーワード:温泉療法,緑藻Mucidosphaerium sp. RG92株,抗炎症作用,活性酸素種,皮膚炎,関節炎
【1】はじめに
温泉療法によりアトピー性皮膚炎,乾癬,関節リウマチなどの炎症性疾患の症状が緩和されることが知られている(Nasermoaddeli and Kagamimori, 2005;Matz et al., 2003).これらの効果には,温泉の化学的作用や物理的作用が関与するという報告もあるが,温泉には多種多様な微生物が生息することが確認されており,それらが温泉の効果効能の一部を担う抗炎症作用を有する可能性も示唆されている(Matz et al., 2003;Hou et al., 2013).
イタリアのアバノ市の温泉泥(ファンゴ)からは,ラン藻(シアノバクテリア)の一種であるPhormidium sp. ETS-05株が単離されており,それが産生する成分はファンゴの主な薬理効果である抗炎症作用を有することが報告されている(Bruno et al., 2005;Ulivi et al., 2011).ETS-05株から得られるモノガラクトシルジアシルグリセロール(MGDG)やジガラクトシルジアシルグリセロール(DGDG)等の糖脂質は,マウスの炎症性浮腫を抑制する(Bruno et al., 2005).このMGDGは,軟骨細胞において,15-デオキシ-Δ 12,14-プロスタグランジンJ2(15-デオキシ-Δ 12,14-PGJ2)の産生を介した抗炎症機構により,発痛増強物質であるPGE2の産生および炎症関連因子のインターロイキン6(IL-6),IL-8の発現を抑制すると報告されている(Ulivi et al., 2011).台湾の陽明山温泉地帯からは,Aspergillus terreusが発見された.この真菌から同定された新規メロテルペノイドyaminterritrem Bは,マウスマクロファージ様細胞RAW264.7においてPGE2の合成に関与するシクロオキシゲナーゼ-2(COX-2)の発現を抑制することが報告されているが,作用機序は明確になっていない(Liaw et al., 2015).
活性酸素種(ROS)は,セカンドメッセンジャーとして炎症性疾患における炎症反応を悪化させる(Filippin et al., 2008).カロテノイドや糖脂質等の抗酸化成分は細胞内ROS量を減少させることにより,核内因子κB(NF-κB)を介して炎症関連因子の発現を抑制することが知られている(Kim et al., 2008;Ishii et al., 2017).いくつかの温泉由来の微生物はこのような抗酸化成分を含有することが知られているが(Hirayama and Kishida, 1991;Sato and Moriyama, 2007),これらの抽出物や単離成分の抗炎症作用は検証されていない.以上のことから,温泉由来微生物の抗炎症作用や有効成分,作用メカニズムに関する包括的な研究は緒に就いたばかりであると言える.
我々の研究拠点である大分県別府市は,源泉数で世界一を誇り,療養泉の種類も豊富である(Tsukamoto, 2014).この恵まれた温泉資源を美容と健康の増進に活用するため,別府市内の温泉に生息する微生物に着目し,単離・探索した結果,微細藻類Mucidosphaerium sp. RG92株を発見した(Miyata et al., in press).本稿では,皮膚や関節の細胞におけるRG92株抽出物の薬理作用について解説し,これまでに報告されている温泉微生物との違いや今後の課題を検討した.なお以下の本文中,当該藻類を単にRG92と呼ぶ.
【2】Mucidosphaerium sp. RG92株の同定
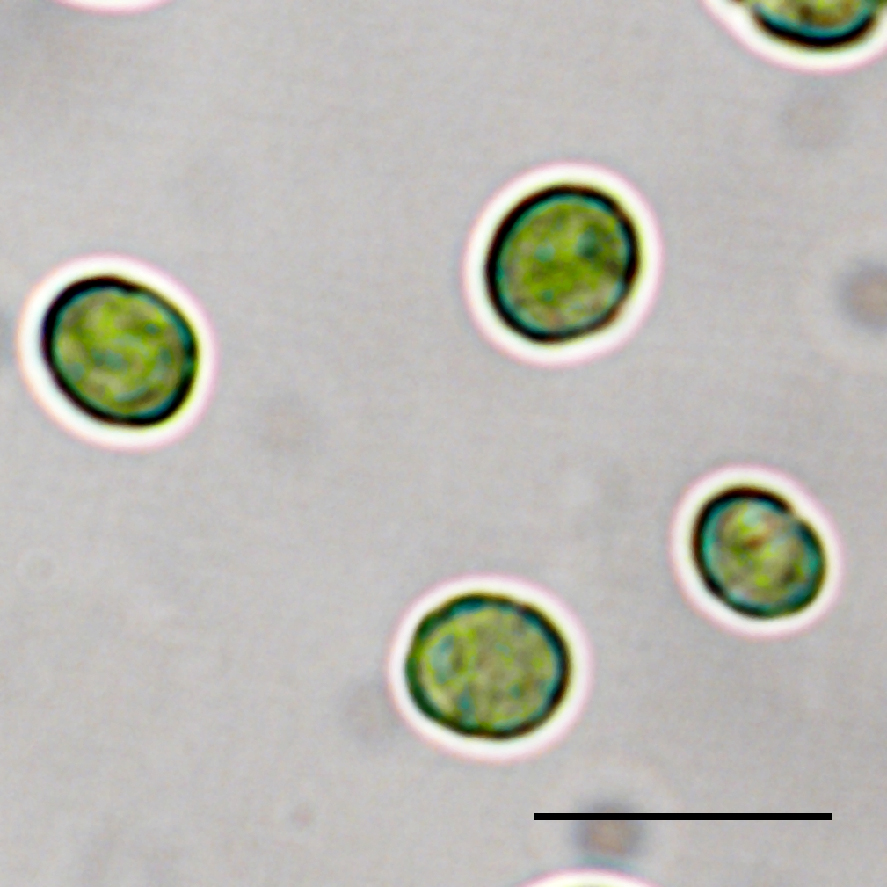
別府市内の温泉(泉質:ナトリウム-塩化物泉)から,Closterium寒天培地でコロニーの形成・採取を繰り返し行うことによりRG92を単離した.18SリボソームRNA遺伝子のDNAシークエンスとBLAST解析から,RG92は緑藻Dictyosphaerium pulchellum(相同率99.39%, アセッション番号 GQ487248)と最も相同性が高いことが判明した.Dictyosphaerium属の一部は,Bockら(2011)によってクロレラ目クロレラ科Mucidosphaerium属に再編成された.RG92は緑色で丸い形をした単細胞の緑藻類であり,直径は5.0 ± 0.7 μmで(図1),前報のMucidosphaerium属の特徴と一致していた(Bock et al., 2011).以上,遺伝子解析と形態学的観察の結果から,RG92は緑藻Mucidosphaerium sp.と結論づけた(Miyata et al., in press).
図1 Mucidosphaerium sp. RG92株の光学顕微鏡像
【3】皮膚細胞における抗炎症作用
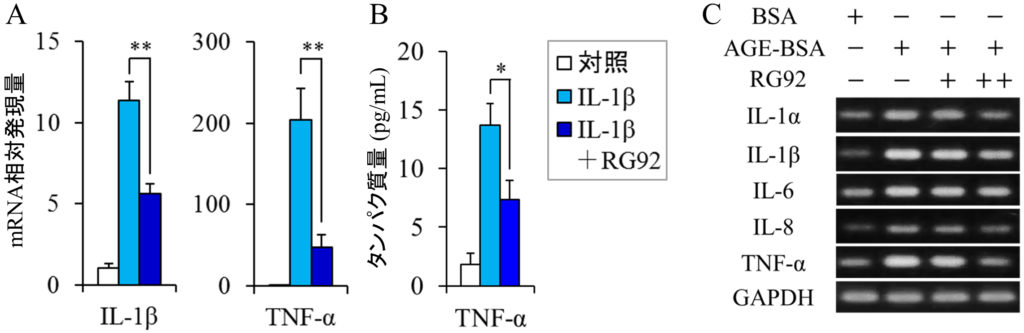
IL-1β,IL-6,TNF-α等の炎症性サイトカインは炎症を引き起こし,アトピー性皮膚炎や円形脱毛症といった炎症性疾患の発症や悪化に関与している(Kasraie and Werfel, 2013;Gregoriou et al., 2010).皮膚や毛髪におけるRG92抽出物の抗炎症作用を検証するために,IL-1βで刺激したヒト真皮線維芽細胞(DF)あるいはヒト頭髪毛乳頭細胞(DPC)を用いて,炎症性サイトカインのmRNAレベルをリアルタイムポリメラーゼ連鎖反応法(PCR)で定量した.DFをIL-1βで処理すると,IL-1β,IL-6,TNF-αのmRNAレベルは顕著に増加した.RG92のエタノール抽出物は,この過剰な遺伝子発現をそれぞれ66.8%,26.1%,88.3%抑制した(図2A).酵素結合免疫測定法(ELISA)を用いて細胞から培養液中に分泌されるサイトカインのタンパク質量を測定したところ,同抽出物はタンパク質レベルにおいても過剰発現したIL-6とTNF-αの量を減少させることがわかった(図2B).DPCにおいても,同様の結果が得られた(図3A,3B).これらの結果から,RG92抽出物は炎症性サイトカインの遺伝子発現を抑えることで,皮膚に関する様々な炎症性疾患を予防・改善することが期待される.
上記に示した炎症性サイトカインは,COX-2,神経成長因子(NGF),マトリックスメタロプロテアーゼ(MMP)等の炎症関連因子を誘導し,皮膚に異常をきたすことが知られている(Tominaga and Takamori, 2013;Bakry et al., 2015;Pillai et al., 2005).RG92抽出物がこれらの炎症関連因子に及ぼす影響を確認するために,DFにおいてこれらの因子のmRNAレベルを測定した.本抽出物は,IL-1βで過剰に誘導されたCOX-2のmRNAの発現を41.2%減少させた(図2C).DNAマイクロアレイ解析では,PGE2を合成するPGE合成酵素の発現が23.3%抑制されることも確認した(Miyata et al., in press).これらのことから,RG92抽出物はアラキドン酸カスケードにおいてCOX-2やPGE合成酵素の発現を抑制することにより,PGE2の産生を抑え,掻痒や疼痛を軽減することが推察される.また,同抽出物はアトピー性皮膚炎の掻痒増強因子として知られているNGFのmRNAレベルを47.9%低下させた(図2C).さらに,皮膚の弾力成分であるコラーゲン等を分解するMMP-1およびMMP-3のmRNAの過剰発現をほぼ完全に抑制し,MMP酵素活性も顕著に阻害した(図2C,2D).以上の結果から,RG92抽出物は,炎症性サイトカインとともにCOX-2,NGF,MMPのような炎症関連因子の遺伝子発現を抑制することで,掻痒,疼痛,シワ・タルミ等の皮膚症状の予防や改善に効果的であることが示唆された.
図2 真皮線維芽細胞におけるMucidosphaerium sp. RG92株抽出物の抗炎症・抗酸化作用
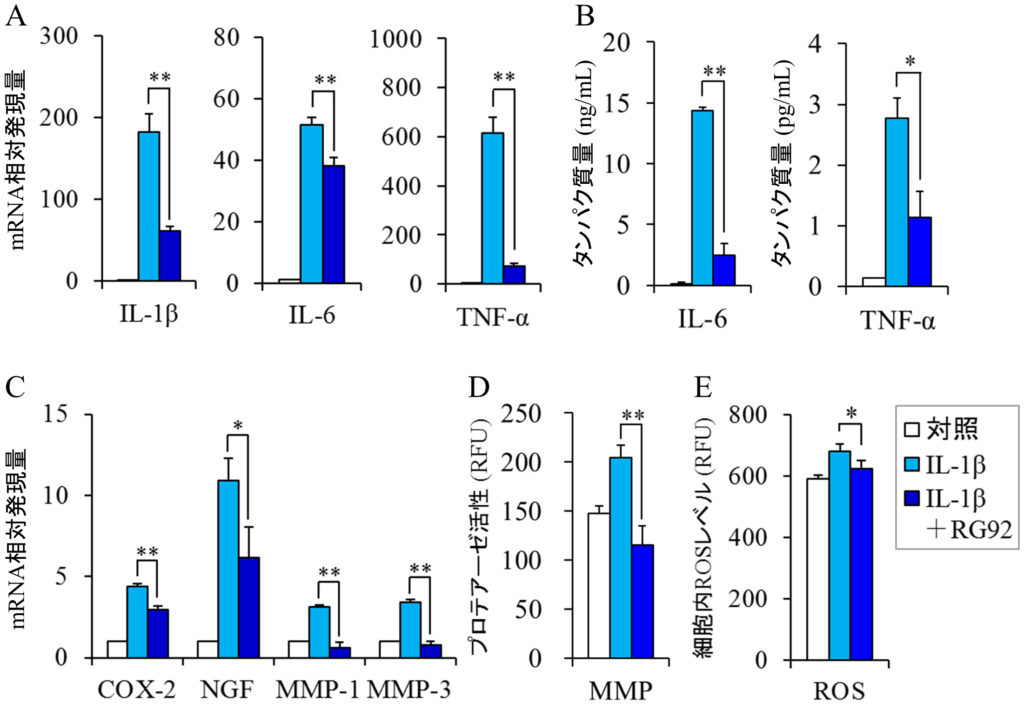
図3 毛乳頭細胞におけるMucidosphaerium sp. RG92株抽出物の抗炎症作用
【4】関節細胞における抗炎症作用
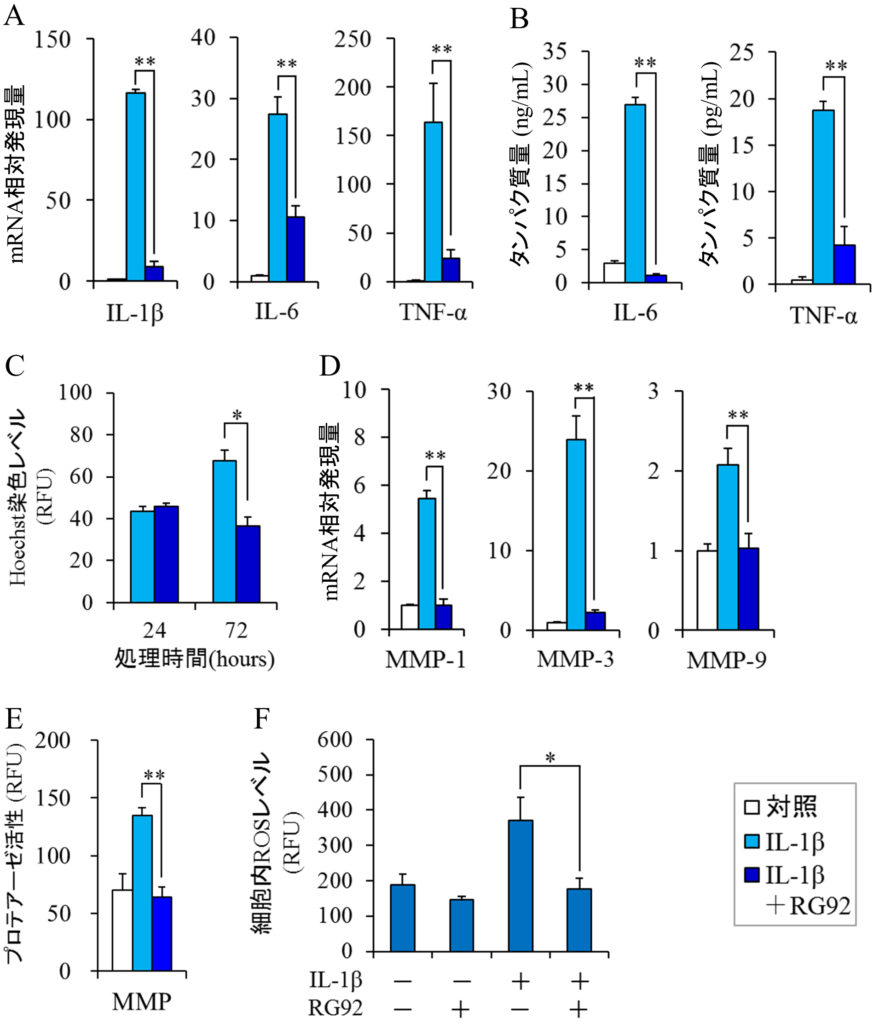
関節リウマチは,①滑膜の炎症,②パンヌス形成(滑膜の肥大化),③軟骨の分解という3段階を経て関節の破壊や機能異常を引き起こす炎症性自己免疫疾患である(Karmakar et al., 2010).RG92抽出物の抗炎症作用を検証するために,IL-1βで刺激した滑膜線維芽細胞(FLS)における炎症性サイトカインのmRNAレベルを測定した.RG92抽出物は過剰に増加したIL-1β,IL-6,TNF-αのmRNA発現をそれぞれ93.1%,64.0%,85.9%抑制し,タンパク質レベルにおいても顕著な抑制が確認された(図4A,4B).加えて,同抽出物はIL-1β刺激による過剰なFLSの増殖をほぼ完全に抑制した(図4C).さらに,Ⅱ型コラーゲンやプロテオグリカン等の細胞外マトリックスを分解して軟骨を破壊する酵素(MMP-1,MMP-3,MMP-9)についても検証した(Rose and Kooyman, 2016).本抽出物はIL-1βによって誘導されたこれら分解酵素のmRNA発現と酵素活性をほぼ完全に抑制した(図4D,4E).以上より,RG92抽出物は,1)炎症性サイトカインの遺伝子発現を抑えることで滑膜の炎症を緩和する,2)FLSの異常増殖を抑えることでパンヌス形成を抑える,3)MMPの遺伝子発現や酵素活性を抑えることで軟骨や骨の分解を阻害する,つまり,関節リウマチの各ステップの進行を防ぐことが期待される.
図4 滑膜線維芽細胞におけるMucidosphaerium sp. RG92株抽出物の抗炎症・抗酸化作用
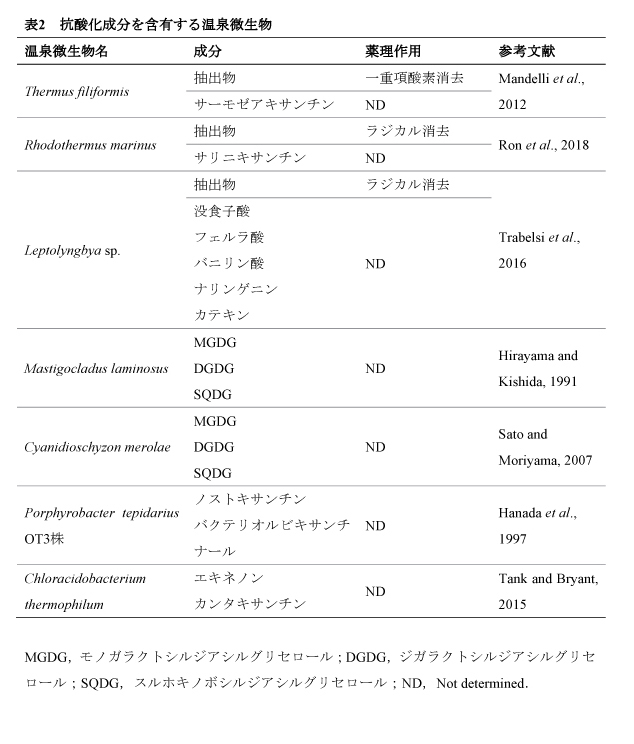
【5】抗酸化作用
以前,我々はDPCにおいて終末糖化産物(AGEs)がROS- NF-κB経路を介して炎症性サイトカインの発現を亢進すること,および,抗酸化成分であるN-アセチルシステインがこの経路を阻害することを見出した(Miyata et al., 2015).この実験系において,RG92抽出物に同様の効果が確認されたので(図3C),RG92抽出物は抗酸化作用を介して,抗炎症作用を発揮する可能性が考えられた.
RG92抽出物の抗酸化活性を確認するために,Caoら(1993)の方法に従って酸素ラジカル吸収能(ORAC)の測定を行った結果,本抽出物のORAC値は178.3 ± 0.9 μmol trolox equivalent/gであった(Miyata et al., in press).現在,美容と健康の分野で広く利用されている微細藻類として緑藻クロレラ属(Chlorella)とラン藻スピルリナ属(Spirulina)がある.Chlorella vulgarisとSpirulina platensisの抽出物における抗酸化活性はそれぞれ~30,~12 μmol trolox equivalent/gと報告されており(Agregán et al., 2018),RG92抽出物はこれらの微細藻類よりも抗酸化作用が高いと言える.実際に,同抽出物はIL-1β刺激により過剰に発生した細胞内ROSを減少させることが確認された(図2E,4F).従って,RG92抽出物の抗酸化成分が細胞内に取り込まれて過剰な細胞内ROSを除去することが抗炎症作用につながる可能性が示唆された.
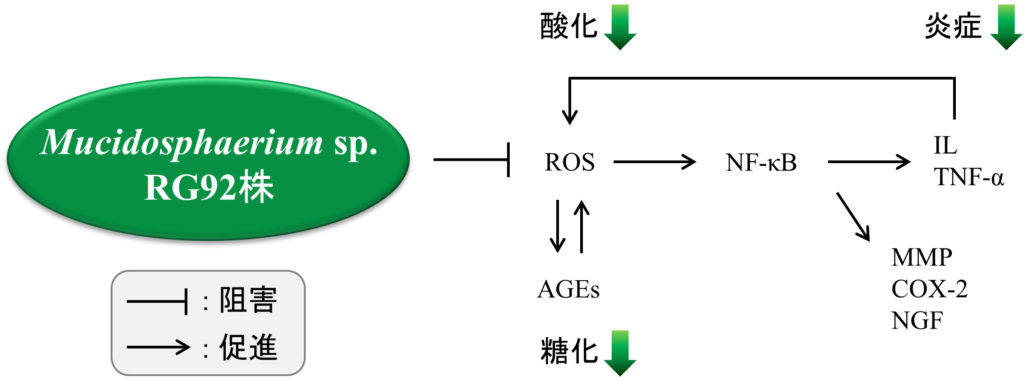
図5 Mucidosphaerium sp. RG92株抽出物の作用機序
【6】考察
これまでに,薬理作用を示すいくつかの温泉微生物が各地で発見されている(表1,2).抗炎症作用については,上述したPhormidium sp. ETS-05株やAspergillus terreus以外にも,Aquaphilus dolomiaeの抽出物がアレルギー性炎症に関与する胸腺間質性リンパ球新生因子やIL-4受容体の発現を抑えることが示されたが,有効成分は特定されていない(Aries et al., 2016).抗酸化作用に関しては,Thermus filiformisのカロテノイド粗抽出物,Rhodothermus marinusやLeptolyngbya sp.のアルコール抽出物に一重項酸素やラジカルの消去作用が報告されている.抗酸化成分の候補として,サーモゼアキサンチン,サリニキサンチン等のカロテノイド,没食子酸,フェルラ酸,バニリン酸等の有機酸,ナリンゲニン,カテキン等のフラボノイドが同定されている(Mandelli et al., 2012;Ron et al., 2018;Trabelsi et al., 2016).この他,様々な温泉微生物で糖脂質(MGDG,DGDG,SQDG)やカロテノイド(ノストキサンチン,バクテリオルビキサンチナール,エキネノン,カンタキサンチン)などの抗酸化成分として知られる物質が確認されているが,それらの薬理作用は検証されていない(表2).
炎症は,さまざまな外部刺激によって引き起こされ,セカンドメッセンジャーとしてROSが深く関与していることが知られている(Filippin et al., 2008).IL-1βやTNF-α等の炎症性サイトカインは,ミトコンドリアの電子伝達系やニコチンアミドアデニンジヌクレオチドリン酸(NADPH)オキシダーゼを介して細胞内のROS量を増加させることが知られている(Kamata et al., 2005;Rousset et al., 2013).我々は,FLSにおいて,IL-1βがミトコンドリアの形態を変調させ,細胞内ROSを増加させることを見出し,RG92抽出物がこのミトコンドリアの形態変調とROSの過剰な発生を抑制することを確認した(Mifude et al., 2017).加えて,RG92抽出物は脂肪細胞においてNADPHオキシダーゼの活性を抑えることも確認している(data not shown).したがって,RG92抽出物は,NADPHオキシダーゼとミトコンドリアの電子伝達系の両方に由来するROSを抑制すると考えられる.また,外因性のROSによって炎症性サイトカインが過剰に分泌されることが知られており(Chen et al., 2010),それらの炎症因子がさらに細胞内ROSを増加させ,炎症が悪化する.このような炎症と酸化の悪循環を食い止めることは重要である.抗炎症作用と抗酸化作用を併せ持つRG92抽出物は,炎症性疾患の効率的な予防・改善に効果的であることが示唆される.
既に,RG92の糖脂質画分に細胞内ROS消去活性や炎症性サイトカインの遺伝子抑制活性があることを見出している(data not shown).更に,RG92に含まれるDGDGの量はMGDGよりも多いことを薄層クロマトグラフィー分析で確認した.一方,温泉由来のラン藻Phormidium sp. ETS-05株に含まれるDGDG量はMGDGよりも少ないことが知られている(Marcolongo et al., 2006).単細胞の緑藻類であるClamydomonas属やChlorella属においても同様の報告がされており(da Costa et al., 2016),DGDGをMGDGよりも多く含むことはRG92の特徴と言えるかもしれない.これらの糖脂質組成の違いにより,RG92抽出物はETS-05株と異なる抗炎症作用のメカニズムを示す可能性がある.実際に,ETS-05株のMGDGは炎症のresolution phase(回復期)において,COX-2の発現亢進を介して15-デオキシ-Δ 12,14-PGJ2を増加させることで抗炎症作用を発揮するとされている(Ulivi et al., 2011).一方,RG92抽出物は,炎症のinitiation phase(初期段階)において,細胞内ROSの減少を介してCOX-2をはじめとする一連の炎症関連因子の遺伝子発現を抑えて抗炎症作用を示すことが示唆された(図2-4).RG92にはルテイン,α-カロテン,β-カロテン等のカロテノイドも含まれている(data not shown).今後,RG92抽出物の抗炎症作用に寄与する成分の構造解析および同定を進め,作用機序の比較検討を行うことで,炎症性疾患の治療薬の開発に向けた有益な知見が得られるであろう.
今回,我々はDF,DPC,FLSといった3種の異なる皮膚や関節由来のヒト初代培養細胞を用いてRG92抽出物の抗炎症作用を示したが,以前の温泉微生物の薬理研究には軟骨細胞や表皮ケラチノサイト等の異なる細胞が用いられている(表1).温泉由来微生物の薬理作用や有効成分,作用メカニズムを包括的に解析する研究は着手されたばかりであり,今後はこれらを網羅的に踏まえた検討が必要である.温泉微生物の生態系との関係に着目した研究も興味深い.
【7】まとめ
別府市内の温泉で発見した緑藻Mucidosphaerium sp. RG92株の抽出物は,皮膚や関節由来の細胞において,一連の炎症関連因子の発現や活性を抑制した.この抗炎症作用には,RG92抽出物の抗酸化活性が関与しているものと考えられる(図5).Mucidosphaerium sp. RG92株は,アトピー性皮膚炎,円形脱毛症,関節リウマチに代表されるような炎症性疾患の予防や改善に有用であることが示唆された.今回の報告は,温泉から発見された単細胞性の緑藻類において初めて抗炎症作用に関する知見を得たものであり,温泉に生息する微生物の薬理学的研究に拍車を掛けるものと期待する.
謝辞 温泉水より単離培養されたRG92に関し,培養をお手伝いいただいた当研究所の青龍若菜氏,山下尚輝氏に感謝致します. RG92の同定にご協力いただいた信州大学大学院総合理工学研究科の亀山真悠氏,伊原正喜准教授に感謝申し上げます.関節細胞研究に関してご助言を賜りました京都産業大学現代社会学部の石飛博之助教,広島大学病院未来医療センターの味八木茂講師に感謝致します.

温泉科学 68巻3号「別府温泉由来微細藻類RG92株の抗炎症作用」はこちらのPDFにて詳細をご確認いただけます。
論文タイトル「炎症性関節炎におけるミトコンドリアの調節と微細藻類RG92抽出物の抑制効果」
要旨
活性酸素種(ROS)の過剰生成は,関節リウマチ(RA)および変形性関節症(OA)などの関節炎の発症や進行に関与している.これらの疾患において,ROSは炎症因子の刺激により滑膜および軟骨細胞のミトコンドリアから副次的に放出される.私たちは,関節炎における主要な炎症メディエーターであるインターロイキン1β(IL-1β)が,ヒト滑膜線維芽細胞(FLS)のミトコンドリアの形態変化や機能に与える影響を調べた.その結果,IL-1β刺激により線維型のミトコンドリアが支配する滑膜細胞の割合が減少し,丸型のミトコンドリアが支配する滑膜細胞の割合が増加することが判明した.さらに,IL-1β処理をしたFLSにおいて細胞内のアデノシン三リン酸(ATP)量は減少したが,それに伴いROS発生量は増加していた.つまり,FLSの炎症刺激時において,ミトコンドリアの形態と機能の間には密接な関係が認められた.これらのミトコンドリアに対するIL-1βの影響は,別府温泉で発見した新種微細藻類Mucidosphaerium sp. RG92(以下RG92株とする)の抽出物によって抑制された.関節炎の進行過程におけるミトコンドリアの形態と機能の変調に関する新しい知見とRG92株抽出物による抑制効果は,炎症性関節炎の新しい治療方法の発展につながるものと期待する.
キーワード:Mucidosphaerium sp. RG92,ミトコンドリア,活性酸素種,ATP,関節炎,IL-1β(Mucidosphaerium sp. RG92, mitochondria, reactive oxygen species, ATP, arthritis, IL-1β)
【1】はじめに
慢性疾患は遺伝的要因や環境的要因などの様々な影響を受ける.関節軟骨および骨の破壊が観察される関節リウマチ(RA)の初期段階では,インターロイキン1β(IL-1β)および腫瘍壊死因子α(TNF-α)などの炎症性サイトカインの量が上昇する(McInnes and Schett, 2011 ; Kapoor et al., 2011 ; Brennan et al., 1998).変形性関節症(OA)における炎症性サイトカインのレベルはRAのそれよりも低いと言われているが,OAでも炎症が引き起こす疼痛は患者の主要な苦痛である(Liu-Bryan and Terkeltaub, 2015 ; Mathiessen and Conaghan, 2017).軟骨および滑膜などの関節組織の恒常性のバランスは,サイトカイン等の細胞内刺激や機械的ストレスを含む細胞外刺激によって変調され(Lotz and Caramés, 2011 ; Miyaki and Asahara, 2012),そのバランスが崩れることにより,滑膜線維芽細胞(FLS)の過剰増殖でパンヌスが形成され,軟骨細胞のアポトーシスが誘導されて軟骨破壊が起こる.さらに,タンパク質分解酵素の増加により,コラーゲンやプロテオグリカンなどの細胞外マトリックスが分解され,骨の破壊が加速される(Bartok and Firestein, 2010).
ミトコンドリアは,細胞内エネルギーであるアデノシン三リン酸(ATP)を供給するだけでなく,カルシウム勾配を緩衝したり,プログラム細胞死を制御したりする真核細胞に不可欠な細胞小器官である(Picard et al., 2013).活性酸素種(ROS)は,主にミトコンドリアにおける酸化的リン酸化の過程で生成されることが知られている.ROSの過剰生成は,慢性疾患の発症におけるセカンドメッセンジャーとして炎症応答を増強するとともに,脂質,タンパク質および核酸などの生体高分子を酸化することで細胞の機能を損なう.細胞の状態や環境ストレスに応答して,ミトコンドリアは分裂タンパク質や融合タンパク質の調節により形態を変化させる.また,ミトコンドリアの機能不全は,様々な炎症性,自己免疫性および加齢性疾患と密接な関係にあることが報告されている(Lotz and Caramés, 2011 ; Hernandez-Aguilera et al., 2013).
ミトコンドリアの機能不全は,ヒトFLSおよび軟骨細胞における炎症反応を促進,悪化させる(Valcarcel-Ares et al., 2014 ; Vaamonde-García et al., 2012).IL-1βは,ROSを介した核内因子κB(NF-κB)経路によってIL-8,シクロオキシゲナーゼ-2およびプロスタグランジンE2などの炎症性サイトカインメディエーターを誘導する.さらに,炎症性サイトカインは軟骨細胞においてミトコンドリアの量を減少させ,膜電位や細胞内ATPレベルの低下およびアポトーシスの誘導をもたらすことも報告されている(Dave et al., 2008).また,関節由来の細胞における炎症反応は抗酸化剤により緩和されることも知られている(Dvir-Ginzberg et al., 2016 ; Nguyen et al., 2017).従って,抗酸化剤や抗炎症剤により,関節組織の炎症応答を制御できる可能性がある.
ミトコンドリア遺伝子の変異が,滑膜組織の炎症レベルと関連していること(Harty et al., 2012),ミトコンドリアの機能損傷によって誘導される過剰なROSは,滑膜の炎症と密接に関係しているとの報告もある(Biniecka et al., 2011 ; Filippin et al., 2008 ; Lepetsos and Papavassiliou, 2016).興味深いことに,RA患者はOA患者と比較して,FLSにおけるミトコンドリアDNAの突然変異の発生率が高く,ミトコンドリアの膜電位や呼吸鎖の機能が低いと言われている(Da Sylva et al., 2005;Kim et al., 2017).従って,RAの発症や進行はOAよりもミトコンドリアの機能異常とより密接に関連している可能性が示唆され,ミトコンドリアの機能改善を目指した治療はRAの方が効果的かもしれない.
軟骨細胞のエネルギー代謝は解糖系が優位であるが,ミトコンドリアでの酸化的リン酸化も重要な役割を担うことが知られている(Cao et al., 2013 ; Martin et al., 2012).例えば,ヒト軟骨細胞をIL-1βやTNF-αで処理すると,ミトコンドリアは断片化され,ATP産生の低下およびスーパーオキシドレベルの上昇が起こる(López-Armada et al., 2006).このような炎症に伴うミトコンドリアの機能変調の解明は,関節症の改善や予防のための新規治療アプローチにつながると考えられる.実際に,TNF遮断治療は,炎症性関節炎における酸化的ストレスおよび低酸素がもたらすミトコンドリア突然変異の誘発を効果的に抑制することが報告されている(Biniecka et al., 2011).
私たちは,別府市内の温泉(泉質:ナトリウム-塩化物泉)から新規の微細藻類Mucidosphaerium sp. RG92株(以下当該藻類をRG92と呼ぶ)を発見し,単離培養した藻体から得られたエタノール抽出物(RG92抽出物)が様々なヒト初代培養細胞における炎症性サイトカインの過剰発現を抑制することを見出した(Miyata et al., in press:前項参照).更に,この抽出物は,FLSにおけるROSの過剰産生を抑制すること,細胞の異常増殖を阻害すること,マトリックスメタロプロテアーゼ(MMP)の遺伝子発現を抑制することが明らかとなった.これらの結果は,RG92抽出物が関節炎の各ステップで進行を防ぐ可能性を示唆している.しかしながら,FLSのミトコンドリアへの影響については不明なままであった.ここでは,IL-1βで刺激されたFLSのミトコンドリアの形態および機能に関する新しい知見とともに,それらに対するRG92抽出物の効果について解説する(Mifude et al., 2017).
【2】ミトコンドリアの形態変化
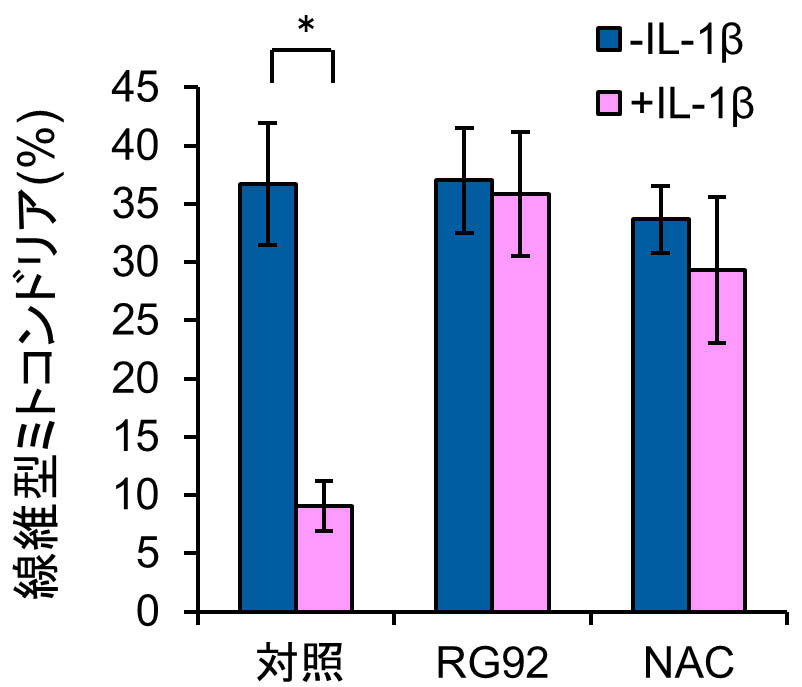
毛乳頭細胞を用いた以前の報告(Mifude and Kaseda, 2015)と同様に,FLSのミトコンドリアは主に線維型および丸型の2つの異なる形態を示した.37%の細胞は線維型ミトコンドリアのみを有し,6%は丸型ミトコンドリアのみを示した.残りの細胞は,線維型と丸型の混合タイプであった(図1,表1).図2と表1に示すように,細胞をIL-1βで処理すると,線維型ミトコンドリアを持つ細胞の割合は低下し(9%),代わりに丸型ミトコンドリアを持つ細胞の割合が増加した(26%).従って,IL-1βによる炎症刺激はミトコンドリア形態のバランスに大きな影響を与えることが判明した.
図1 ヒト滑膜線維芽細胞におけるミトコンドリアの形態
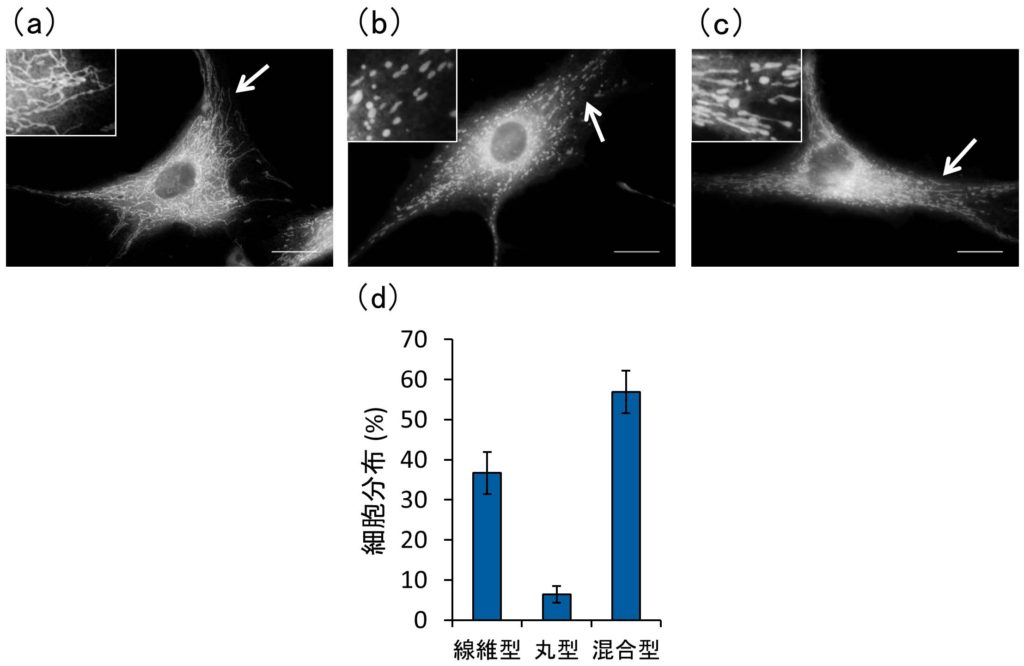
図2 線維型ミトコンドリアの分布に及ぼすRG92抽出物の効果
【3】ミトコンドリアの形態と機能の関係
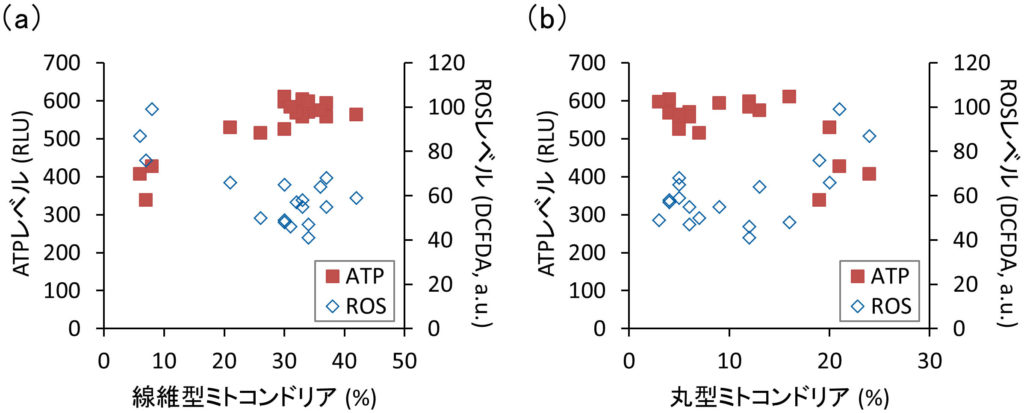
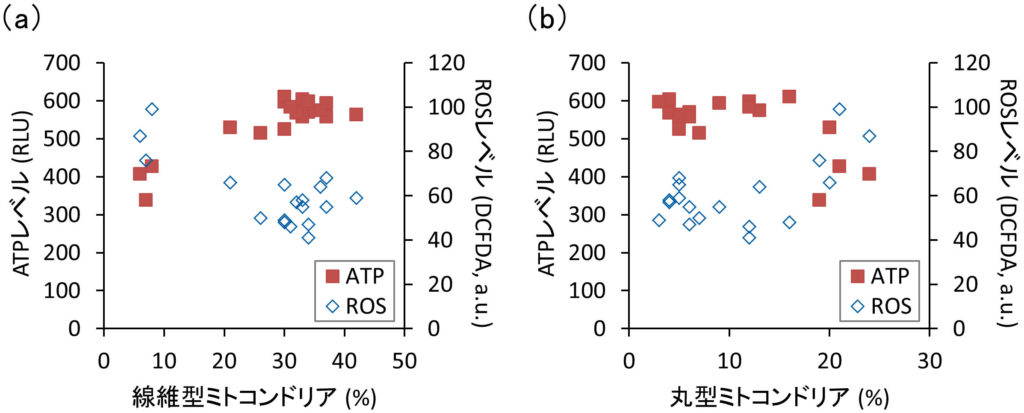
私たちは以前,線維型ミトコンドリアは丸型ミトコンドリアよりも多くのATPを産生することを見出した.さらに,線維型ミトコンドリアは多くのエネルギーを必要とする細胞移動に有益であることを示した(Mifude and Kaseda, 2015 ; Mifude and Kaseda, 2016).そこで,IL-1βの存在下または非存在下でFLSのATP量を調べた.図3に示すように,当サイトカインの存在下で,細胞内ATPレベルは有意に減少し,逆にROSレベルは増加した.したがって,ミトコンドリアの形態学的変化と並行して,IL-1βが関節細胞におけるATP合成反応の脱共役を誘導することが示唆された.事実,図4aに示すように,線維型ミトコンドリアの割合に対するATPおよびROSレベルで強い相関が確認された.また,丸型ミトコンドリアの割合は線維型とは正反対の関係性を示した(図4b).これらの結果は,ミトコンドリアの形態変化がATP合成活性に重要な役割を担うことを意味している.
図3 RG92抽出物によるミトコンドリア脱共役の改善
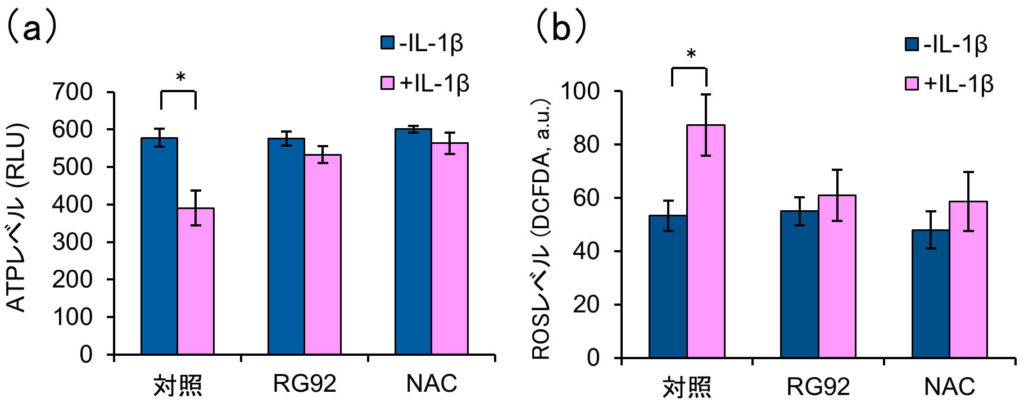
図4 ミトコンドリアの形態と機能の関係
【4】微細藻類Mucidosphaerium sp. RG92株の効果
FLSがIL-1βで刺激された場合,TNF-α,IL-1β,IL-6およびMMP-1,MMP-3,MMP-9の遺伝子レベルが上昇するが,RG92抽出物は,これらRAの発症に関わる因子の過剰発現を抑制した(Miyata et al., in press:前項参照).これらの結果はRG92が関節疾患の改善や予防に有用なツールになることを示唆している. 今回更に,RG92抽出物が炎症刺激したFLSにおけるミトコンドリアの形態と機能に及ぼす効果を調べた.図2および表1に示すように,IL-1β存在下では線維型ミトコンドリアを有する細胞の割合は有意に減少するが,RG92抽出物によってその割合が正常レベルに戻り,炎症性サイトカインの影響を抑制する効果があることが示された.加えて,同抽出物は,IL-1βが引き起こすATP産生の阻害およびROS生成の増加の効果を打ち消した(図3).従って,RG92抽出物は炎症刺激によるミトコンドリアの酸化的リン酸化反応の阻害を抑制する作用を持ち合わせていることが分かった.本抽出物の効果は,代表的なROSスカベンジャーであるN-アセチルシステイン(NAC)に類似していた. 今後,RG92抽出物に含まれる機能分子を同定し,作用機序の比較検討を行いたい.
【5】まとめ
滑膜細胞のミトコンドリアの形態と機能を調べ,IL-1β刺激により線維型ミトコンドリアを持つ細胞の割合が減少し,ATPレベルの低下とROSの過剰産生がもたらされることを示した.RG92抽出物は,IL-1βによるミトコンドリアの形態変調及び機能の低下を抑制することが判明した(図5).ミトコンドリアに対するRG92抽出物の効果は,その抗炎症作用と密接に関連している可能性がある(Liu-Bryan and Terkeltaub, 2015).これらの研究成果がRAやOAの新しい治療方法の確立につながるものと期待する.
図5 関節リウマチにおけるミトコンドリアの形態および機能の変調とRG92抽出物の効果
謝辞 温泉水より単離培養された新種の藻類に関し,培養をお手伝いいただいた当研究所の青龍若菜氏,山下尚輝氏に感謝致します.また,滑膜線維芽細胞を譲渡頂きました京都産業大学現代社会学部の石飛博之助教,広島大学病院未来医療センターの味八木茂講師に感謝致します.

温泉科学 68巻3号「炎症性関節炎におけるミトコンドリアの調節と微細藻類RG92抽出物の抑制効果 」はこちらのPDFにて詳細をご確認いただけます。